Hiện nay chưa có thuốc hoặc vaccin chống lại COVID-19 hiệu quả. Tuy nhiên, giữ gìn vệ sinh và tăng cường hệ thống miễn dịch được coi như là chiến lược phòng ngừa hiệu quả. Do đó, cần khẩn trương nghiên cứu các hợp chất thích hợp để tăng cường hệ thống miễn dịch và ngăn chặn hoạt động của SARS-CoV-2 bởi các loại thuốc kháng virus hiện có (ví dụ: virus cúm) không có tác dụng chống lại SARS-CoV-2.
Tác giả: RehamSamirHamida, Ashwag Shami Mohamed
Abdelaal Ali, Zakiah Nasser Almohawes, Afrah E.Mohammed, Mashael Mohammed Bin-Meferij
Đăng trên tạp chí: Biomedicine & Pharmacotherapy; Volume 133,
January 2021, 110974
CÁC PHÁT HIỆN NỔI BẬT CỦA NGHIÊN CỨU
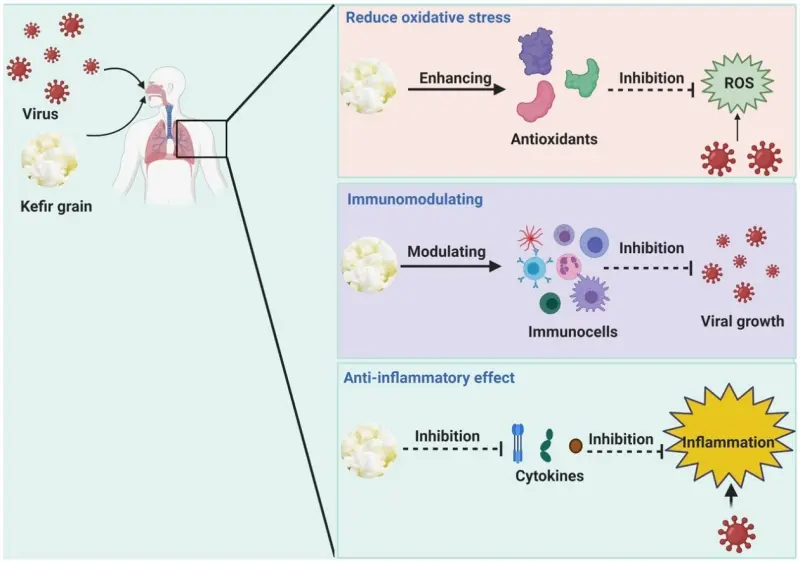
• Kefir và các dẫn xuất của chúng có khả năng ức chế virus bằng cách điều chỉnh các phản ứng của hệ thống miễn dịch, gián đoạn quá trình bám dính của virus.
• Các cơ chế kháng virus của kefir liên quan đến việc tăng cường sản xuất đại thực bào và thúc đẩy hoạt động của cytokine gây tiền viêm.
• Kefir có hoạt tính chống viêm bằng cách ức chế hoạt động của các cytokine tiền viêm như IL-1β, TNF-α và IL-6.
• Sử dụng Kefir (và các sản phẩm của nó) như một chất ức chế sự xuất hiện của cytokine tiền viêm ở bệnh nhân COVID-19 có thể là một phương pháp khả thi.
TÓM TẮT
TÓM TẮT
Bệnh virus Corona 2019 (COVID-19) là một bệnh truyền nhiễm gọi là ‘hội chứng hô hấp cấp tính nghiêm trọng corona virus 2′ (SARS-CoV-2) gây ra bởi corona virus. Một số học giả đã thử nghiệm thuốc kháng virus và các hợp chất để hạn chế nhiễm COVID-19. ‘Kefir’ là một thức uống từ sữa lên men tương tự như sữa chua, được làm từ hạt men kefir. Kefir và thành phần probiotic của nó có thể điều chỉnh hệ thống miễn dịch để ức chế nhiễm virus (ví dụ: Zika, viêm gan C, cúm, rotavirus). Các cơ chế kháng virus của kefir liên quan đến việc thúc đẩy sản xuất cụm tế bào CD4+, CD8 +, immunoglobulin (Ig) G + và IgA + B, tế bào T, bạch cầu trung tính, cũng như cytokine (ví dụ: interleukin (IL)-2, IL-12, interferon gamma-γ).
Kefir có thể hoạt động như một chất chống viêm bằng cách giảm biểu hiện của IL-6, IL-1, TNF-α và interferon-γ. Do đó, kefir có khả năng ức chế đáng kể corona virus. Ở đây, chúng tôi xem xét một số nghiên cứu đặc biệt về kefir và thành phần lợi khuẩn của chúng giúp chống lại nhiễm virus, cũng như thảo luận về sự phát triển chế độ ăn uống bổ sung kefir nhằm chống lại sự nhiễm SARS-CoV-2 thông qua điều chỉnh đáp ứng miễn dịch.
1. GIỚI THIỆU
Nhiễm virus có thể đe dọa tính mạng con người [1]. Nhiễm trùng cấp tính đường hô hấp có liên quan đến virus, nấm và vi khuẩn, gây ra tỷ lệ mắc bệnh và tử vong ở người và làm suy giảm miễn dịch [2].
Các họ virus: Paramyxoviridae, Orthomyxoviridae, Adenoviridae, Picornaviridae và Coronaviridae có thể gây nhiễm trùng đường hô hấp. Họ Coronaviridae là virus có màng bọc và RNA sợi đơn. Coronaviruses (COVs) có bộ gen RNA lớn nhất (30 kB), có khả năng lây nhiễm cho người và động vật [3,4].
COVs có thể lây nhiễm qua đường hô hấp ở người lớn tuổi, những người mắc bệnh mãn tính, cũng như trẻ em [5]. Nhiễm CoV cũng có thể dẫn đến rối loạn hệ tiêu hóa, hô hấp, gan và thần kinh trung ương [6,7].
CoV là lý do chính cho sự bùng phát của hội chứng hô hấp Trung Đông (MERS) ở Ả Rập Xê Út vào năm 2012 và hội chứng hô hấp cấp tính nặng (SARS) ở Trung Quốc vào năm 2002-2004 [8], [9], [10]. Các CoV khác nhau liên quan đến SARS đã được nghiên cứu ở dơi với tư cách là vật chủ mang virus[7,11,12].
Vào ngày 12 tháng 12 năm 2019, nhiễm trùng CoV dẫn đến viêm phổi đã được phát hiện ở Vũ Hán (tỉnh Hồ Bắc, Trung Quốc) [13]. Loại virus mới này được phát hiện có 96% tương đồng với bộ gen CoV từ dơi [14].
Tổ chức Y tế Thế giới (WHO) đã gọi hội chứng hô hấp cấp tính CoV mới này là ‘coronavirus 2′ (SARS-CoV-2) vào ngày 11 tháng 2 năm 2020. SARS-CoV-2 bắt đầu từ Trung Quốc và hiện nay đã lây lan trên toàn thế giới. WHO đặt tên cho căn bệnh này là COVID-19. Tính đến ngày 25 tháng 10 năm 2020, có hơn 42,624,910 trường hợp dương tính với COVID-19 và 1,149,928 trường hợp tử vong trên thế giới [15].
Các chiến lược được dùng để chống lại nhiễm virus là phát triển loại vaccin phù hợp hoặc một loại thuốc kháng virus hiệu quả [16]. Cơ chế hoạt động của hầu hết các loại vaccin là thúc đẩy các tế bào T hỗ trợ loại 1 (Th1) hoặc cụm tế bào biệt hóa CD4+ để tạo ra các cytokin khác nhau, chẳng hạn như interferon (IFN)-γ, interleukin (IL)-2 và IL-12.
Loại thứ hai giúp kích thích sự trưởng thành của các tế bào T gây độc và tăng cường độc tính tế bào của các tế bào tiêu diệt tự nhiên (NK) để tiêu diệt các tế bào bị nhiễm virus [17].
Buisman và công sự [18] báo cáo rằng vaccin sản xuất globulin miễn dịch (Ig)A để bảo vệ cơ thể. Cơ chế hoạt động của thuốc kháng virus chủ yếu dựa trên việc tăng cường hệ thống miễn dịch, ức chế sự gắn kết của virus với các tế bào.
Hiện nay chưa có thuốc hoặc vaccin chống lại COVID-19 hiệu quả. Tuy nhiên, giữ gìn vệ sinh và tăng cường hệ thống miễn dịch được coi như là chiến lược phòng ngừa hiệu quả. Do đó, cần khẩn trương nghiên cứu các hợp chất thích hợp để tăng cường hệ thống miễn dịch và ngăn chặn hoạt động của SARS-CoV-2 bởi các loại thuốc kháng virus hiện có (ví dụ: virus cúm) không có tác dụng chống lại SARS-CoV-2 [19,20].
Các sản phẩm tự nhiên có thể tăng cường hệ thống miễn dịch và ức chế nhiễm virus. ‘Kefir’ là một thức uống từ sữa lên men tương tự như sữa chua, được lên men từ hạt men kefir. Kefir được coi như một chế phẩm sinh học lành mạnh (tức là lợi khuẩn có thể nâng cao sức khỏe bằng cách cải thiện / khôi phục hệ vi sinh vật đường ruột) và đã được sản xuất trên quy mô thương mại [21].
Đối với con người, kefir có tiềm năng kháng virus, kháng khuẩn và chống viêm. Kefir đã được chứng minh có thể ức chế nồng độ enzyme chuyển đổi angiotensin (ACE), chuyển hóa cholesterol, đẩy nhanh quá trình chữa lành vết thương, ức chế sự phát triển của khối u và cải thiện các triệu chứng hen suyễn và dị ứng [22], [23], [24], [25].
Kefir và các dẫn xuất của chúng (ví dụ: polysaccharides, protein, peptide) có thể ức chế hoạt động của virus bằng cách điều chỉnh phản ứng của hệ thống miễn dịch và / hoặc gây gián đoạn quá trình bám dính của virus [26,27]. Chúng cũng hoạt động như tác nhân chống viêm bằng cách ức chế hoạt động của các cytokine tiền viêm như IL-1β, yếu tố hoại tử khối u (TNF)-α và IL-6 [27]. Do đó, kefir và các sản phẩm phụ của nó có thể được sử dụng làm tác nhân chống lại virus.
Đánh giá này tập trung vào cơ chế, khả năng kháng virus đặc biệt là kháng virus SARS-CoV-2 của kefir, từ đó giúp các nhà nghiên cứu sàng lọc hoạt động kháng virus dựa trên sản phẩm lên men tự nhiên này.
2. CƠ CHẾ SINH BỆNH HỌC CỦA COVID-19
Cơ chế này không được hiểu đầy đủ. Tuy nhiên, nhìn nhận từ phương thức lây nhiễm của SARS-CoV và MERS-CoV thì có thể cung cấp một vài thông tin về cơ chế lây nhiễm do SARS-CoV-2 gây ra.
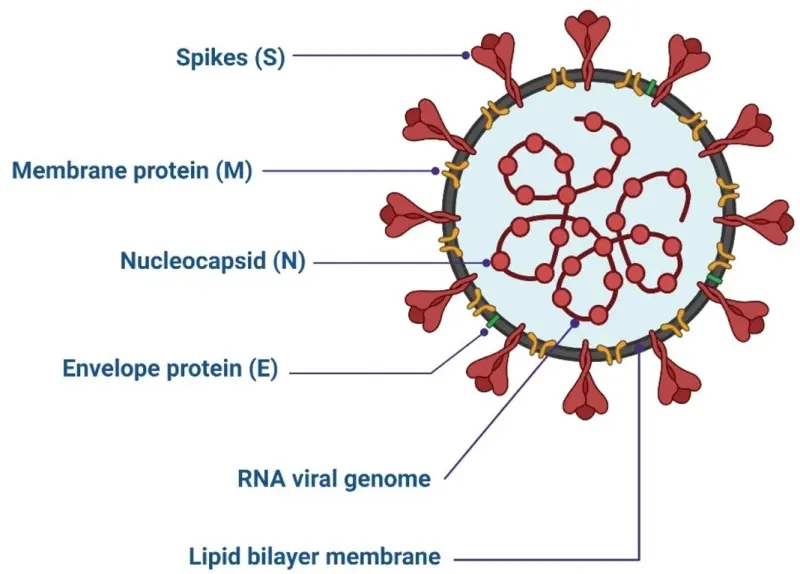
Để lắp ráp và lây nhiễm CoV, bốn protein cấu trúc được sử dụng. Protein chịu trách nhiệm cho sự gắn kết giữa virus và vật chủ là glycoprotein ‘spike’ (S) [28]. Protein màng (M) chịu trách nhiệm cho việc tạo thành hình dạng, màng cong và liên kết nucleocapsid của virus [29]. Giải phóng virus và gây bệnh là nhiệm vụ của protein vỏ (E) [30,31]. Việc liên kết với bộ gen RNA của virus là do protein nucleocapsid (N) chịu trách nhiệm, nó cũng rất quan trọng đối với quá trình sao chép của virus (Hình 1) [32].
CoV phải tiếp cận tế bào chất để sao chép [33], vì vậy chúng phải tương tác với các thụ thể của tế bào [34,35]. Glycoprotein S từ SARS-CoV-2 tương tác với các thụ thể ACE2 trên màng tế bào phổi (tương tự như đã thấy với SARS-CoV) [14].
Sau khi enzyme proteolytic phân hủy glycoprotein S thì virus và màng tế bào hợp nhất, từ đó dẫn đến sự xâm nhập của bộ gen virus vào tế bào chất [36]. Serine protease xuyên màng loại II là protein liên quan đến ACE2 và có thể tăng cường phản ứng tổng hợp virus [37,38]. Sau đó, sự sao chép RNA bộ gen và phiên mã mRNA của virus xảy ra, (tổng hợp RNA bộ gen từ RNA sợi âm) (Hình 2) [39].
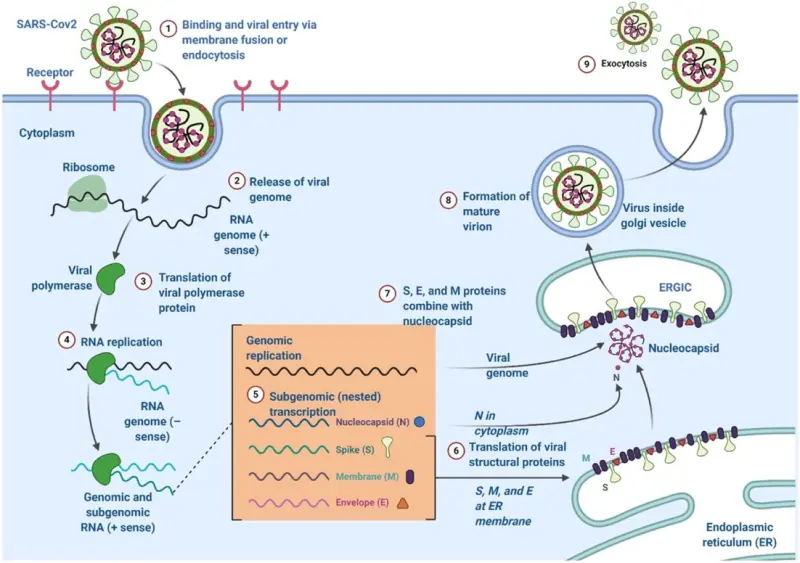
Do đó, protein S, E và M mới được hình thành và kết hợp vào mạng lưới nội chất hoặc thể Golgi. Protein nucleocapsid và RNA gen kết hợp hình thành nucleocapsid. Virus phát triển thành khoang trung gian giữa mạng lưới nội chất-Golgi [19]. Sau đó, protein N làm biến mất bộ gen của virus để hình thành virus trưởng thành [40]. Tiếp đó, các phần tử virus kết hợp với màng sinh chất để giải phóng virus [41].
Những người bị nhiễm SARS-CoV-2 thường có triệu chứng ho khan, sốt, khó thở, đau đầu và viêm phổi dẫn đến suy hô hấp và thậm chí tử vong [14]. Tuy nhiên, các dấu hiệu như vậy được coi là nhẹ hơn nếu so sánh với các triệu chứng mà SARS và MERS gây ra [4]. Thời gian ủ bệnh từ 2–10 ngày dễ dàng làm lây truyền SARS-CoV-2 từ người sang người, qua bàn tay, giọt bắn, qua ho và hắt hơi [42]. Thuốc kháng virus không bao giờ có thể tiêu diệt hoàn toàn do virus có khả năng thay đổi cấu trúc di truyền [43].
3. ĐẶC ĐIỂM VÀ TIỀM NĂNG CỦA KEFIR
Kefir được biết đến và sử dụng rộng rãi đầu tiên ở Đông Âu, Balkan và Kavkaz. Nó là một loại sữa lên men có chút cồn, axit [44,45]. Đường kính trung bình của hạt men kefir rơi vào khoảng 0,3–3,5 cm [46,47]. Hạt men Kefir gồm các probiotic tồn tại trong mạng lưới phức tạp của protein và polysaccharides [48,49].
Kefir được tạo nên khi trộn hạt men kefir (gồm các vi khuẩn axit lactic (LAB) khác nhau và nấm men) với sữa tươi và ủ ở nhiệt độ phòng. Trong thời gian ủ, hệ lợi khuẩn của men kefir phát triển và nhân lên, dẫn đến việc bổ sung hoặc mất đi vi khuẩn, nấm men và gen của chúng [22,24,25]. Kefir dễ dàng được tạo nên theo các phương pháp truyền thống và thương mại khác nhau [50].
Kefir có nhiều lợi ích [[51], [52], [53]] điều này liên quan đến hệ lợi khuẩn và các hợp chất chúng tạo nên [54,55]. Ngoài ra, một đặc tính có thể thương mại khác chính là kefir có thể sử dụng như 1 loại thức ăn giàu dinh dưỡng giúp hệ vi sinh có lợi trong đường ruột phát triển khoẻ mạnh [[56], [57], [58]].
Polysaccharide chính trong hạt kefir là kefiran dị hợp tử, bao gồm một lượng tương đương galactose và glucose chủ yếu được hình thành bởi Lactobacillus kefiranofaciens [59]. Kefiran làm tăng độ nhớt của kefir sữa [60]. Kefiran có khả năng tạo gel có độ nhớt tốt ở nhiệt độ thấp và được sử dụng để cải thiện các sản phẩm lên men [61]. Hơn nữa, kefiran có đặc tính chống ung thư, kháng nấm, kháng khuẩn quan trọng [62,63], cũng như điều hòa miễn dịch hoặc bảo vệ biểu mô [45], chống viêm [64], chữa bệnh [53], và chống oxy hóa [47].
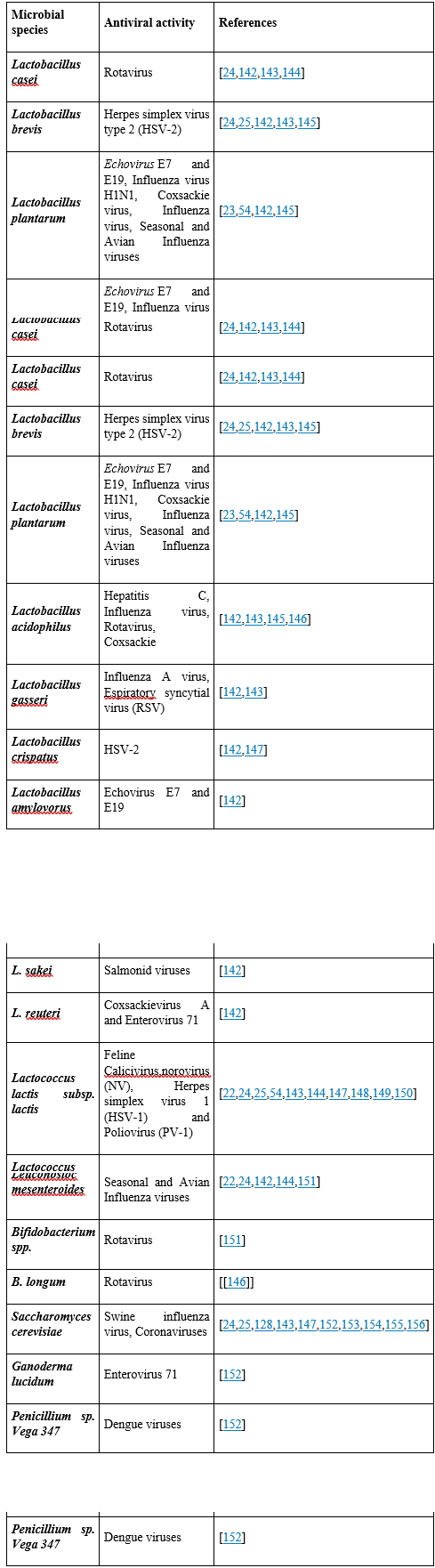
Các nhóm vi khuẩn phổ biến nhất trong men kefir và kefir sữa là Lactococcus, Streptococcus, Lactococcus lactis phân loài lactis, Lactobacillus delbrueckii phân loài bulgaricus, L. helveticus, L. casei phân loài pseudoplantarum, L. skefiri, L. kefir, L. brevis và Streptococcus thermophiles, chiếm khoảng 37–90% lượng vi khuẩn (Bảng 1) [[22], [23], [24], [25]]. Trong nhiều thế kỷ, những vi khuẩn này đã được biết là có lợi cho sức khỏe [65]. Ngoài ra, các vi khuẩn khác, chẳng hạn như Leuconostoc mesenteroides hoặc các loài nấm men, có thể chiếm ưu thế trong một số loại men kefir [25]. Đặc điểm phân biệt kefir với các sản phẩm sữa lên men khác là hạt kefir bao gồm nhiều quần thể nấm men [66,67].
Thành phần của kefir phụ thuộc vào loại sữa được sử dụng trong quá trình lên men. Giá trị dinh dưỡng của kefir dựa trên hàm lượng các hợp chất được tạo ra từ quá trình lên men (ví dụ: khoáng chất, đường, carbohydrate, protein, peptide, vitamin, chất béo) cũng như các chất chuyển hóa thứ cấp (ví dụ: catechin, vanillin, axit ferulic và axit salicylic) [68]. Vitamin B1, B2, B5 và C, các yếu tố ở nồng độ cao (ví dụ: canxi, magiê, kali, natri) và nồng độ thấp (ví dụ: kẽm, đồng, sắt) cũng như các axit amin thiết yếu (ví dụ: serine, threonine, alanine, lysine, valine, isoleucine, methionine, phenylalanine, tryptophan) có mặt trong kefir [[69], [70], [71]].
Những thành phần này có vai trò quan trọng trong việc cải thiện hệ thống miễn dịch, tiêu hóa, tăng cường trao đổi chất, cân bằng năng lượng, chữa bệnh, và cân bằng nội môi [[70], [71], [72]]. Nisoli và cộng sự báo cáo rằng các axit amin có chứa kefiran giúp kéo dài tuổi thọ con người và cải thiện tình trạng của bệnh nhân chấn thương sọ não nghiêm trọng [73].
3.1. Phản ứng của hệ thống miễn dịch với việc bổ sung kefir
Vi sinh vật đường ruột là tổng số vi sinh vật, vi khuẩn, virus, động vật nguyên sinh, nấm, và vật liệu di truyền của chúng có trong đường tiêu hóa. Vi sinh vật đường ruột có khả năng điều trị / phòng ngừa bệnh, với số lượng phù hợp thì chúng có thể điều chỉnh các đáp ứng miễn dịch [65,74]. Vi sinh vật đường ruột đã cho thấy hiệu quả chống lại virus cúm và Streptococcus pneumoniae ở động vật [75].
Các loại probiotic khác nhau cho thấy các khả năng khác nhau trong việc hỗ trợ và điều chỉnh các hệ thống miễn dịch bẩm sinh và miễn dịch đáp ứng [76]. Chúng chứa các chất kích thích miễn dịch, bao gồm axit lipoteichoic, peptidoglycans và axit nucleic [77]. Probiotics cũng có thể làm giảm mức độ nghiêm trọng của nhiễm trùng ở hệ tiêu hóa [76] và đường hô hấp [78,79]. Các probiotic có khả năng ngăn chặn hoạt động cũng như sự xâm nhập của virus vào tế bào vật chủ bằng cách liên kết với virus [80].
Cơ chế hoạt động là tăng cường các hợp chất miễn dịch, cũng như tăng cường các vi khuẩn, axit lactic và hydro peroxide như các tác nhân kháng virus [81]. Các hoạt động của lợi khuẩn có thể hoạt động thông qua tác động trực tiếp đến các tế bào vi khuẩn sống hoặc tác dụng gián tiếp thông qua vi sinh vật tiết ra các chất chuyển hóa [82]. Möller và cộng sự đã chứng minh rằng các chất chuyển hóa có trong sữa lên men có thể tăng cường sản xuất tế bào lympho và phân tử Ig [83].
Một số tác giả đã thảo luận về ảnh hưởng của kefir đối với hệ thống miễn dịch. Trong mô hình chuột, Yasui và cộng sự đã nghiên cứu hoạt tính kháng virus của Bifidobacterium breve [84]. Kết quả chỉ ra rằng B. breve bảo vệ đường hô hấp dưới khỏi sự nhiễm virus. Các nghiên cứu khác đã chỉ ra lượng mầm bệnh ở mũi cũng giảm sau khi tiêu thụ sữa lên men [85,86].
Vinderola và cộng sự chỉ ra hiệu quả của kefir (và các chế phẩm probiotic khác) như một chất tăng cường hệ thống miễn dịch. Họ chỉ ra rằng kefir có thể điều chỉnh đáp ứng miễn dịch bằng cách tăng số lượng tế bào ruột và phế quản IgA +, nó cũng có khả năng thực bào đối với đại thực bào phúc mạc và phổi ở chuột [87].
Ngoài ra, họ cũng báo cáo rằng sự biểu hiện của các cytokine IL-4, IL-6 và IL-10 tăng lên trong lớp đệm ruột non của những con chuột sử dụng kefir. Perdigon và cộng sự báo cáo rằng những con chuột ăn sữa lên men cho thấy tăng các phản ứng miễn dịch như tăng số lượng tế bào IgA +, hoạt động của đại thực bào và các phản ứng kháng thể đặc hiệu [[88], [89], [90]]. Can và cộng sự chứng minh rằng mức IgM tăng lên sau khi cho cá hồi Çoruh (Salmo coruhensis) sử dụng kefir [91]. Thoreux và Schmucker đã nghiên cứu hoạt động điều hòa miễn dịch của kefir ở chuột con được tiêm độc tố tả trong tá tràng [92].
Họ phát hiện ra rằng mức độ IgA chống độc tố tả đã tăng lên trong huyết thanh, mảng Peyer, hạch bạch huyết mạc treo ruột, lá lách và lớp đệm ruột của những con chuột ăn kefir so với những con chuột không tiêu thụ kefir. Họ cho rằng kefir gây ra phản ứng miễn dịch niêm mạc ruột chống lại độc tố tả ở chuột trưởng thành, nhưng không hiệu quả ở chuột già. Các nghiên cứu sâu hơn cho thấy sự tăng cường biểu hiện của các cytokine IL-1α, IFN-γ, TNF-α, IL-6 và IL-10 sau khi sử dụng kefiran (được sản xuất bởi kefir microflora L. kefiranofaciens) cho các nhóm chuột khác nhau [26]. Tương tự, sự gia tăng nồng độ IFN-γ trong huyết thanh đã được quan sát thấy ở các nhóm chuột bị tiêm bệnh đậu mùa, cho thấy phương thức hoạt động của kefir tương tự như đã đề cập ở trên [93]. Ta có thể thấy rằng có sự giống nhau giữa cơ chế hoạt động của kefir và hoạt tính của vaccin để điều trị nhiễm virus vì phương pháp điều trị dựa trên IFN cho thấy tiềm năng điều trị cho bệnh nhân nhiễm virus viêm gan C [94,95].
Tác dụng điều hòa miễn dịch của kefir cũng tương tự với các dẫn xuất của nó. Một số nghiên cứu đã chứng minh tiềm năng của quần thể probiotic của kefir (ví dụ: LAB) trong việc điều chỉnh các phản ứng miễn dịch cụ thể và không đặc hiệu [96].
Chủng probiotic mới L. kefiranofaciens M1 có trong men kefir đã cho thấy các hoạt động điều hòa miễn dịch, chống dị ứng, chống hen suyễn và chống viêm đại tràng in vitro và in vivo ở chuột không có vi trùng [97]. L. reuteri và L. plantarum đã cho thấy tác dụng tích cực đối với chuột nhiễm virus viêm phổi [98]. Khoảng thời gian từ 2 đến 12 tuần khi tiêu thụ L. plantarum HEAL 9 và L. paracasei 8700 làm giảm nguy cơ mắc các bệnh nhiễm trùng cảm lạnh do rhinovirus gây ra ở người thông qua cảm ứng tế bào CD4 + và CD8 + [99]. Cavicchioli và cộng sự. đã chứng minh rằng L. lactis subspecies lactis có hoạt tính ức chế đáng chú ý chống lại herpes poliovirus-1 [100].
Hơn nữa, Nanis và cộng sự cho thấy rằng việc sử dụng các lợi khuẩn như Lactobacillus acidophilus và các loài Bifidobacteria giúp tăng khả năng chữa bệnh đối với các phương pháp điều trị nhiễm virus viêm gan C (HCV) bằng cách điều chỉnh IFN-α và ribavirin [95]. Weiss và cộng sự báo cáo rằng việc sử dụng L. acidophilus NCFM dẫn đến việc điều chỉnh các gen liên kết với các tế bào đuôi gai có nguồn gốc từ tủy xương của chuột thông qua việc kích hoạt sự biểu hiện của các gen bảo vệ virus theo cách thức phụ thuộc vào thụ thể-2 – IFN-β [101].
Adiloğlu và cộng sự chứng minh ảnh hưởng của việc uống kefir đối với hệ thống miễn dịch bẩm sinh của con người [102]. Họ cho 18 người tham gia khỏe mạnh sử dụng kefir trong 6 tuần, và đo nồng độ TNF-α, IL-1, IL-5, IL-8 trong huyết thanh, yếu tố tăng trưởng biến đổi-β, hemoglobin, creatinine và alanine aminotransferase. Kết quả cho thấy tăng phản ứng miễn dịch đối với loại Th1, giảm phản ứng của loại Th2. Ngoài ra, việc giảm biểu hiện IL-8 sau khi bổ sung kefir có thể kiểm soát phản ứng viêm bằng cách ức chế hóa chất điều hòa bạch cầu trung tính. Ngược lại, sự gia tăng biểu hiện IL-5 có thể tăng cường bài tiết IgA trong niêm mạc đường tiêu hóa, dẫn đến phản ứng miễn dịch hiệu quả hơn trong lòng ruột (Hình 3).
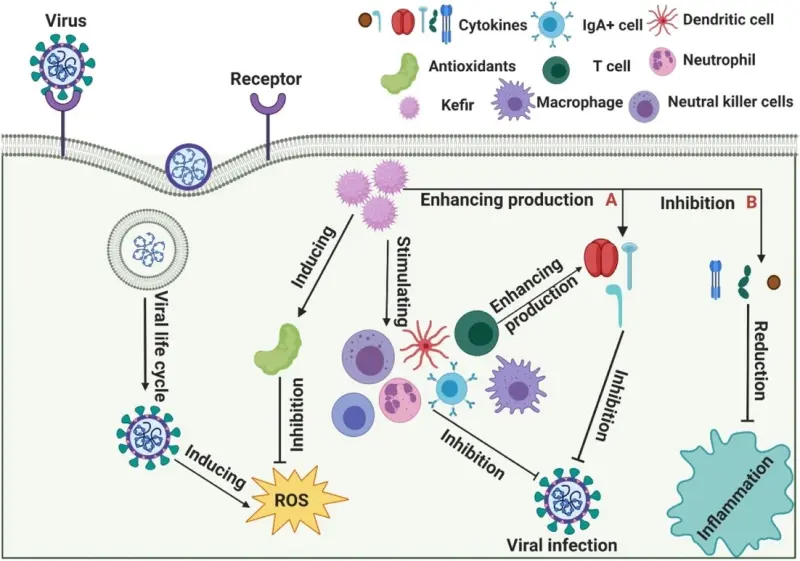
(A) Kefir tăng cường phản ứng miễn dịch bằng cách kích thích sản xuất cytokine, bao gồm interferon gamma (IFN-γ), interleukin (IL) -2 và IL-12. (B) Kefir ức chế phản ứng viêm bằng cách ức chế sản xuất cytokine, chẳng hạn như IL-6, IL-1 và yếu tố hoại tử khối u (TNF) -α.
3.2. Hoạt động chống viêm của kefir
Nhiễm virus có liên quan đến sự biểu hiện quá mức của các tế bào cytokine. Ví dụ, COVID-19 có liên quan đến việc kích hoạt quá mức tế bào T cảm ứng và tổng hợp thêm các cytokine tiền viêm (đặc biệt là IL-6). Hành động như vậy được gọi là ‘cơn bão cytokine’, và được coi là một biến chứng đe dọa tính mạng bệnh nhân được điều trị bằng liệu pháp miễn dịch dựa trên kháng thể. Bên cạnh đó, các cytokine khác như IL-1, TNF-α và IFN-g cũng được hình thành. Tất cả các sản phẩm đều tham gia và dẫn đến rò rỉ huyết tương, tính thấm thành mạch và đông máu nội mạch [103,104]. Giavanni và cộng sự gợi ý mối quan hệ giữa ‘cơn bão cytokine’ và các triệu chứng viêm phổi do SARS-CoV-2 gây ra [104]. Không có sự gia tăng nào về viêm phổi do SARS-CoV-2 được báo cáo ở những bệnh nhân bị rối loạn miễn dịch và đang dùng thuốc ‘khóa’ cytokine. Các học giả đã suy đoán rằng những bệnh nhân mắc các bệnh trung gian miễn dịch dùng thuốc ức chế IL-6 (hoặc các hợp chất ức chế con đường miễn dịch trong quá trình sản xuất IL-6 hoặc trung gian truyền tín hiệu IL-6) có thể được bảo vệ khỏi bệnh viêm phổi do SARS-CoV-2.
Chen và cộng sự. đã nghiên cứu các hoạt động chống viêm và chống oxy hóa của kefir peptit chống lại vật chất dạng hạt nhỏ hơn 4 μm (PM4.0) gây ra viêm phổi ở chuột đồng hợp tử chuyển gen-kappa B (NF-κB) -luciferase + / + [27]. Kết quả cho thấy rằng các peptide kefir có tác dụng chống viêm mạnh thông qua việc giảm biểu hiện của các cytokine tiền viêm IL-lβ, IL-4, IL-6 và TNF-α trong mô phổi bằng cách ức chế tín hiệu NF-κB. Ngoài ra, các peptide hoạt động như các chất chống oxy hóa làm giảm mức độ của các loại oxy phản ứng thông qua việc kích thích hoạt động của tổng số superoxide dismutase trong phổi. Rosa và cộng sự báo cáo rằng 10 tuần sử dụng kefir có thể làm giảm biểu hiện của các cytokine tiền viêm (IL-1β), các dấu hiệu stress oxy hóa (malondialdehyde, hydroperoxide) trong mô mỡ của chuột bị tăng huyết áp [105].
Andrade và cộng sự nói rằng dùng kefir làm giảm 42% biểu hiện TNF-α / IL-10 và giảm 50% biểu hiện IL-6 (tiền viêm), đồng thời với việc tăng cường biểu hiện IL-10 (chống viêm) [106]. Chiết xuất polysaccharide đông khô từ kefir Tây Tạng đã cho thấy tác dụng ức chế mạnh mẽ của hyaluronidase với hoạt độ tối thiểu ở mức 2,08 mg/mL [105]. Seo và cộng sự báo cáo rằng các túi ngoại bào từ kefir làm giảm tình trạng viêm trong tế bào ruột bằng cách ức chế sự tổng hợp các cytokine tiền viêm [107]. Ngoài ra, họ chứng minh rằng có sự sụt giảm trọng lượng cơ thể và giảm chảy máu trực tràng khi những con chuột bị viêm ruột được điều trị bằng các túi ngoại bào có nguồn gốc từ Lactobacillus kefir.
Một nghiên cứu quan trọng của Morsy và cộng sự đã chứng minh uống kefir có thể mang lại lợi ích đáng kể cho bệnh nhân nhiễm HCV (hepatitis-C virus) mãn tính [108]. Ngoài ra, họ cho thấy có sự cải thiện đáng kể đối với bệnh nhân nhiễm HCV nếu họ sử dụng kefir, từ đó cho thấy khả năng kích thích hệ thống miễn dịch, tác dụng chống viêm và chống oxy hóa của kefir. Carasi và cộng sự đã nghiên cứu hoạt tính chống viêm của L. kefiri CIDCA 8348, làm giảm sự biểu hiện của các chất trung gian tiền viêm trong các mảng Peyer và các hạch bạch huyết mạc treo, nhưng tăng cường sản xuất IL-10 [109]. Ngoài ra, ở hồi tràng, IL-10, chemokine (mô típ C-X-C) ligand-1 và mucin 6 được cảm ứng, trong khi ở đại tràng thì mucin-4 được điều hòa và sự biểu hiện của IFN-g, yếu tố kích thích tế bào hạt-đại thực bào, và các gen IL-1b được điều hòa.
3.3. Hoạt tính kháng virus của kefir
Sự gia tăng đáng kể số lượng các bệnh do virus, đặc biệt là các bệnh do các loại virus mới nổi (Chikungunya, Dengue, Ebola, Zika, SARS-CoV-2) đã tàn phá sức khỏe cộng đồng trên toàn thế giới [106.110]. Ngoài ra, chưa có đủ loại thuốc giúp ngăn chặn sự phát triển của tình trạng kháng thuốc, kháng virus.
Mối quan hệ chặt chẽ giữa dinh dưỡng của con người, hệ thống miễn dịch và vai trò của chúng trong việc ức chế các bệnh truyền nhiễm đặt một nền tảng để phát triển các sản phẩm tăng cường hệ thống miễn dịch [111]. Một phân tích cho thấy probiotic và prebiotic (các hợp chất trong thực phẩm đóng vai trò là thức ăn cho các vi sinh vật có lợi như vi khuẩn và nấm giúp tăng cường hoạt động của chúng) có thể tăng cường khả năng sinh miễn dịch với cúm ở người lớn [112].
Liên quan đến thuốc kháng virus có ít tác dụng phụ, một số học giả đã nghiên cứu xem liệu các sản phẩm probiotic có thể được sử dụng như một biện pháp khắc phục cùng với các tác nhân kháng virus hay không [[113], [114], [115]]. de Andrade và cộng sự đã chứng minh rằng kefir (37,5 μg/mL) có khả năng chống lại virus Zika thông qua việc ức chế tác động lên tế bào biểu mô, hoặc bằng cách đối kháng lại tác động của virus đối với sự tăng sinh của tế bào lympho T [106].
Việc sử dụng L. kefiri (100 μg / mL) giúp tăng sự phát triển của các cytokine kháng virus và các tế bào đuôi gai có nguồn gốc monocyte của người, từ đó chúng có thể được sử dụng làm chất kháng virus và chống ung thư [116]. Nấm men, là một trong những thành phần của kefir, đã được chứng minh là nơi nhân bản của virus RNA như HCV và SARS; đặc điểm này giúp hiểu được cơ chế giảm sao chép của virus. Khoảng 100 gen không cần thiết của nấm men ảnh hưởng đến sự sao chép của virus RNA của một số thực vật (ví dụ, virus gây còi cọc cà chua, virus khảm Brome), vì vậy nấm men cũng có thể ảnh hưởng đến các virus RNA khác của người [117,118]. Parsons và cộng sự đã phân lập amantadine hydrochloride từ nấm men và cho thấy nó có khả năng kháng virus (Hình 4) [119].
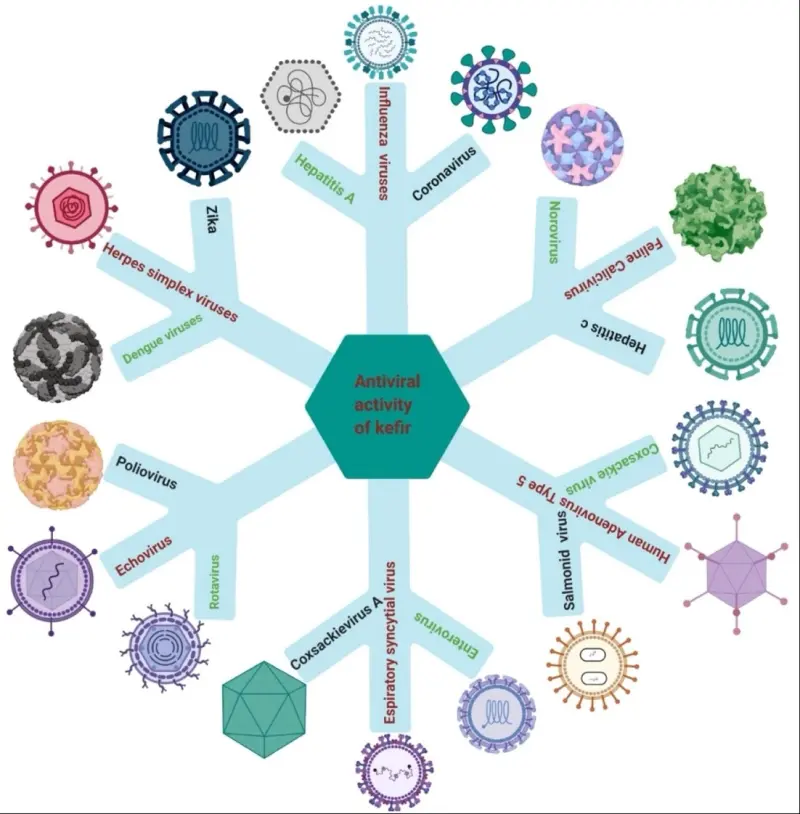
3.3.1. Viêm phổi do virus gây ra
Virus cúm mùa có thể được chống lại bằng liệu pháp kháng virus và vaccin. Tuy nhiên, cách điều trị này thường ít có hiệu quả ở những người bị ức chế miễn dịch hoặc người già. Hơn nữa, tính linh hoạt di truyền cao của virus cản trở vaccin và thuốc kháng virus hoạt động hiệu quả [120]. Trong những tình huống này, việc sử dụng probiotic có thể giúp chống lại virus cúm [121].
Chủng vi khuẩn axit lactic Enterococcus faecium NCIMB 10.415 có thể hạn chế hoạt động của virus cúm thông qua việc tiếp xúc và tương tác trực tiếp [20]. Choi và cộng sự đã nghiên cứu tác dụng kháng virus của dịch nổi không có tế bào (CFS) của năm loại sữa chua lên men kỵ khí với L. acidophilus, L. rhamnosus, L. plantarum, Streptococcus thermophilus và Bifidobacterium bifidum so với bảy loại virus RNA (bao gồm cả virus cúm) [122]. Họ chỉ ra rằng sữa chua với probiotic có thể nâng cao tác dụng thuốc và thực phẩm lên men từ sữa. Maruo và cộng sự đã nghiên cứu tiềm năng kháng virus của sữa lên men với phân loài Lactococcus lactis sản xuất exopolysaccharide ở chuột [123]. Họ đã chứng minh rằng phổi của nhóm chuột được điều trị bằng L. lactis từ sữa chua Cremoris có sự giảm đáng kể lượng virus so với nhóm đối chứng. Goto và cộng sự đã điều tra kết quả kháng virus của L. acidophilus không sống và sống ở những con chuột bị nhiễm virus cúm (H1N1).
Họ cho rằng sự cải thiện hoạt động của tế bào NK trong phổi được tạo ra bởi một số cytokine và chemokin kháng virus sau khi sử dụng L. acidophilus có thể bảo vệ chống lại lây nhiễm virus cúm [124]. Một nghiên cứu so sánh giữa một loại thuốc có sẵn trên thị trường chống lại virus cúm (H1N1) và L. plantarum cho thấy L. plantarum có hiệu quả cao hơn [125]. L. rhamnosus đã cải thiện tỷ lệ sống của chuột bằng cách thúc đẩy phản ứng miễn dịch dịch thể và tế bào, đồng thời cải thiện khả năng đề kháng của vật chủ chống lại sự lây nhiễm virus cúm [120]. Hơn nữa, Bae và các đồng nghiệp đã sàng lọc các đặc tính kháng virus của L. plantarum và Leuconostoc mesenteroides lên virus mùa ở con người và virus cúm gia cầm [121]. Họ báo cáo rằng sự nhân lên của virus trong phổi chuột đã được kiểm soát đáng kể bởi những probiotic này. Lactobacillus gasseri có một số tác dụng quan trọng, [121] và cho thấy khả năng chống lại virus RSV, là tác nhân gây bệnh chính của viêm phổi và viêm phế quản ở trẻ em [126]. Số lượng virus RSV ở phổi chuột giảm đáng kể sau khi điều trị bằng L. gasseri, và một mô hình tương tự được quan sát thấy biểu hiện của các cytokine tiền viêm do nhiễm virus RSV.
Một nghiên cứu về protein của tế bào cho thấy protein hoạt hóa CBP liên quan đến SNF2 là một phân tử có hoạt tính sinh học của L. gasseri đối với RSV [126]. Ngoài ra, b-glucan của Saccharomyces cerevisiae đã cho thấy tác dụng chống lại virus cúm lợn bằng cách tăng sản xuất IFN-g và oxit nitric [127]. Frieman và cộng sự đã thiết kế một thí nghiệm cụ thể để phát hiện các phân tử nhỏ chịu trách nhiệm ngăn chặn sự sao chép của SARS-CoV dựa trên sự ức chế của chúng đối với protein phi cấu trúc 3 (nsp3) hoặc protease giống papain (PLP). Cơ sở lý luận cho việc sàng lọc này là sự biểu hiện tăng cường của nsp3 ở S. cerevisiae gây ra sự tăng trưởng chậm đáng kể của phenotype này [128].
PLP rất quan trọng đối với sự nhân lên của virus. Để khám phá những phân tử nào chịu trách nhiệm ngăn chặn sự sao chép của SARS-CoV, một thí nghiệm với nấm men đã được thiết kế cho hoạt động của PLP. Một tập hợp các phân tử đã được sàng lọc để kiểm tra tác dụng ức chế PLP của chúng và duy trì sự tăng trưởng. NSC158362 đã ngăn chặn sự sao chép của SARS-CoV, nhưng không ảnh hưởng đến hoạt động protease, deubiquitinase hoặc kháng IFN của nsp3, điều này cho thấy một cơ chế ức chế sao chép SARS- trong đó hoạt động PLP không rõ ràng. Thay vào đó, sự ức chế trực tiếp thông qua sửa đổi chức năng PLP có thể được mong đợi. Hơn nữa, hoạt động của các protease PLP bị ức chế trong một thử nghiệm về các tế bào điều trị bằng chất ức chế NSC158011 (Bảng 1).
Bảng 1. Probiotic trong kefir và hoạt động kháng virus của chúng.
3.3.2. Rotavirus
Rotavirus là nguồn gốc của bệnh tiêu chảy ở trẻ sơ sinh và trẻ nhỏ. Một số nghiên cứu đã chứng minh rằng các loài Lactobacillus (ví dụ: L. casei và L. acidophilus) và Bifidobacterium (ví dụ: B. longum) có hoạt động chống lại rotavirus [114.129.130]. Hoạt động của các loài L. casei và Bifidobacterium chống lại nhiễm rotavirus đã được ghi nhận bằng cách tăng tổng hợp protein NSP4 và giải phóng Ca2+. Nghiên cứu cho thấy tác động của rotavirus giảm đi nhờ giảm sự phá hủy các tế bào (Bảng 1) [114].
3.3.3. Virus herpes simplex (HSV)
HSV là nguyên nhân hàng đầu gây nhiễm herpes, có thể phát triển ở nhiều bộ phận của cơ thể, nhưng thường phát hiện ở bộ phận sinh dục (HSV-2) hoặc miệng (HSV-1) [100,[131], [132], [133]]. Phân loài L. lactis lactis, L. Rhamnosus, L. brevis, và L. crispatus có thể chống lại HSV-1 và HSV-2 [100]. Một nghiên cứu gần đây cho thấy vi khuẩn phân lập từ L. lactis có hoạt tính ức chế HSV-1 và được sử dụng làm thuốc kháng virus mới [100]. Hơn nữa, Khani và cộng sự tuyên bố rằng L. rhamnosus cải thiện khả năng sống sót của đại thực bào để loại bỏ HSV-1 [131]. L. brevis có tác dụng ức chế sinh sản HSV-2 liên quan đến vật liệu tổng hợp có trọng lượng phân tử > 10 kDa có thể xảy ra do thành phần bề mặt tế bào vi khuẩn không chứa protein, chịu nhiệt [132]. Mousavi và cộng sự đã sàng lọc hoạt động ức chế của L. crispatus chống lại HSV-2 trong các dòng tế bào Vero và HeLa của động vật có vú: [133] L. crispatus xuất hiện để ‘bắt’ các hạt HSV-2. Hơn nữa, việc hình thành L. crispatus trên bề mặt tế bào có thể ngăn chặn các thụ thể HSV-2 và tránh sự xâm nhập của virus vào tế bào trong giai đoạn đầu của nhiễm trùng (Bảng 1).
3.3.4. Enterovirus
Enterovirus là nguồn gốc của nhiều bệnh nhiễm trùng nhẹ. Tuy nhiên, nhiễm enterovirus ở hệ thần kinh trung ương có thể gây ra các rối loạn sức khỏe nghiêm trọng [134]. Hầu hết các enterovirus sinh sản trong đường tiêu hóa, vì vậy LAB có thể chống lại chúng trong đường tiêu hóa [134]. Nhiều nghiên cứu đã chỉ ra hoạt động của probiotic trên thị trường dưới dạng thuốc kháng virus chống lại enterovirus [134,135]. Vào năm 2016, hai chế phẩm sinh học probiotic có bán trên thị trường được nghiên cứu về hoạt tính kháng virus.
Lactobacillus reuteri Protectis và Lactobacillus casei Shirota đã được kiểm tra để chống lại enterovirus 71 (EV71), coxsackievirus loại A (CA), chủng 6 (CA6) và CA16 (mầm bệnh chính gây ra bệnh tay chân miệng) trong ruột kết và các dòng tế bào cơ xương của người. L. reuteri Protectis có khả năng đáng kể trong việc chống lại EV71 [135]. Các tác giả cho rằng kết quả kháng virus đạt được thông qua tương tác vật lý giữa các phần tử virus và vi khuẩn, điều này ngăn chặn sự xâm nhập của virus vào tế bào chủ của động vật có vú. Kết quả kháng virus không được ghi nhận đối với L. casei Shirota. Sunmola và cộng sự đã kiểm tra hoạt tính kháng virus của LAB L. plantarum và L. amylovorus, chống lại enterovirus [134].
Họ đã chứng minh hoạt tính kháng virus của L. plantarum và L. amylovorus trong tế bào vi khuẩn, CFS và môi trường nuôi cấy (broth culture) chống lại echovirus 7 (E7) và E19 trước và sau khi điều trị. Ngoài ra, các chủng L. plantarum, L. Acidophilus, L. rhamnosus và các dẫn xuất của chúng cũng có khả năng ức chế coxsackievirus, được thể hiện bởi (Bảng 1) [122,136].
3.3.5. Các loại virus khác
Virus thực phẩm, chẳng hạn như norovirus (NV) và virus viêm gan A, là những mối quan tâm lớn về sức khỏe cộng đồng đòi hỏi sự phát triển của các phương pháp mới và hiệu quả để ngăn chặn nhiễm virus do thực phẩm [137]. Aboubakr và cộng sự xác định hoạt tính kháng virus của probiotic LAB chống lại calicivirus ở mèo (một chất thay thế cho norovirus của người) [137].
Họ đã chứng minh rằng việc sử dụng phân loài L. lactis dẫn đến giảm số lượng virus. L. reuteri cho thấy hoạt động đáng kể chống lại coxsackievirus loại A bằng cách tương tác trực tiếp giữa vi khuẩn và virus làm suy yếu khả năng xâm nhập của coxsackievirus loại A vào tế bào chủ [135]. Hơn nữa, việc sử dụng các probiotic như L. acidophilus và các loài Bifidobacteria cho thấy tăng hiệu quả phương pháp điều trị kháng HCV bằng cách điều chỉnh IFN-α và ribavirin (Bảng 1) [95].
4. KẾT LUẬN
Đại dịch COVID-19 đang tàn phá trên toàn thế giới và là mối quan tâm lớn đối với khoa học. Một loại vaccin cụ thể chống lại SARS-CoV-2 không có sẵn, nhưng các tác nhân kháng virus (ribavirin, acyclovir, ganciclovir, thuốc ức chế neuraminidase) đang được nghiên cứu [19]. Tuy nhiên, bất kỳ phương pháp điều trị chống lại COVID-19 đều phải liên quan đến hệ thống miễn dịch.
Kefir và các thành phần của nó có vai trò điều tiết các phản ứng miễn dịch. Chúng có khả năng chống lại virus Zika, HCV, virus viêm gan B, virus cúm (H1N1), HSV, rhinovirus và retrovirus.
Một số bệnh nhân COVID-19 chết sau phản ứng viêm nghiêm trọng do ‘cơn bão cytokine’ liên quan đến 1 L-6, IL-1, TNF-α và IFN-γ. Một giải pháp được đề xuất để bảo vệ bệnh nhân là ức chế chức năng IL-6 hoặc sử dụng một hợp chất để ức chế viêm. Kefir có thể ức chế hoạt động của cytokin tiền viêm. Sử dụng kefir (và probiotic của nó) như một chất ức chế biểu hiện cytokine tiền viêm ở bệnh nhân COVID-19 là một biện pháp khả thi.
Sự sao chép SARS CoV-2 phụ thuộc vào pH, từ đây làm sáng tỏ mối liên hệ giữa tiêu thụ kefir và khả năng thay đổi pH của nó [44,45]. Các nghiên cứu đã báo cáo độ pH của kefir có tính axit (pH 4,6) [21,138]. Tính axit này có liên quan đến các quần thể vi khuẩn có tính axit khác nhau [139.140]. Rea và cộng sự báo cáo rằng độ pH có tính axit của hạt men kefir cản trở các hoạt động gây bệnh [139]. Do khả năng tạo ra các chất chuyển hóa thứ cấp có tính axit và để chúng không bị phân hủy, kefir có thể thay đổi độ pH ở một khu vực cụ thể khi nó được tiêu thụ. Sự kết hợp của CoV xảy ra ở độ pH kiềm nhẹ [141], vì vậy việc xác định mối liên hệ giữa việc tiêu thụ kefir, sự thay đổi độ pH ở một vị trí cụ thể trên cơ thể và nhiễm virus là rất đáng giá.
Dựa trên tất cả các nghiên cứu được thực hiện với kefir và các probiotic của nó, kefir có thể hoạt động như một tác nhân bảo vệ nhằm chống lại virus.
Tài liệu tham khảo
[1] O. Kanauchi, A. Andoh, S.AbuBakar, N. Yamamoto, Probiotics and paraprobiotics in viral infection:
clinical application and effects on the innate and acquired immune systems,
Curr. Pharm. Des. 24 (6) (2018) 710–717. [2] D.T. Jamison, J.G. Breman, A.R.
Measham, G. Alleyne, M. Claeson, D.B. Evans, et al., Disease Control Priorities
in Developing Countries, The World Bank, 2006. [3] K. Pyrc, B. Berkhout, L. van
der Hoek, Identification of new human coronaviruses, Expert Rev. Anti. Ther. 5
(2) (2007) 245–253. [4] Y. Chen, Q. Liu, D. Guo,
Emerging coronaviruses: genome structure, replication, and pathogenesis, J.
Med. Virol. 92 (4) (2020) 418–423. [5] G. Gerna, G. Campanini, F.
Rovida, E. Percivalle, A. Sarasini, A. Marchi, et al., Genetic variability of
human coronavirus OC43-, 229E-, and NL63-like strains and their association
with lower respiratory tract infections of hospitalized infants and
immunocompromised patients, J. Med. Virol. 78 (7) (2006) 938–949. [6] Y. Chen, D. Guo, Molecular
mechanisms of coronavirus RNA capping and methylation, Virol. Sin. 31 (1)
(2016) 3–11. [7] X.-Y. Ge, J.-L. Li, X.-L. Yang,
A.A. Chmura, G. Zhu, J.H. Epstein, et al., Isolation and characterization of a
bat SARS-like coronavirus that uses the ACE2 receptor, Nature 503 (7477) (2013)
535–538. [8] A.M. Zaki, S. Van Boheemen,
T.M. Bestebroer, A.D. Osterhaus, R.A. Fouchier, Isolation of a novel
coronavirus from a man with pneumonia in Saudi Arabia, N. Engl. J. Med. 367
(19) (2012) 1814–1820. [9] J. Cui, F. Li, Z.L. Shi, Origin
and evolution of pathogenic coronaviruses, Nat. Rev. Microbiol. 17 (3) (2019)
181–192. [10] Y. Fan, K. Zhao, Z.L. Shi, P.
Zhou, Bat coronaviruses in China, Viruses. 11 (3) (2019). [11] B. Hu, L.P. Zeng, X.L. Yang,
X.Y. Ge, W. Zhang, B. Li, et al., Discovery of a rich gene pool of bat
SARS-related coronaviruses provides new insights into the origin of SARS
coronavirus, PLoS Pathog. 13 (11) (2017), e1006698. [12] L. Yang, Z. Wu, X. Ren, F.
Yang, G. He, J. Zhang, et al., Novel SARS-like betacoronaviruses in bats,
China, 2011, Emerg Infect Dis. 19 (6) (2013) 989–991. [13] N. Chen, M. Zhou, X. Dong, J.
Qu, F. Gong, Y. Han, et al., Epidemiological and clinical characteristics of 99
cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study,
Lancet 395 (10223) (2020) 507–513. [14] P. Zhou, X.-L. Yang, X.-G.
Wang, B. Hu, L. Zhang, W. Zhang, et al., A pneumonia outbreak associated with a
new coronavirus of probable bat origin, Nature. 579 (7798) (2020) 270–273. [15] Organization WH, Coronavirus
Disease (COVID-19) Pandemic, 2020. [16] K. Dhama, K. Karthik, R.
Khandia, S. Chakraborty, A. Munjal, S.K. Latheef, et al., Advances in designing
and developing vaccines, drugs, and therapies to counter Ebola virus, Front.
Immunol. 9 (2018) 1803. [17] P. Baskar, G. Collins, B.
Dorsey-Cooper, R. Pyle, J. Nagel, D. Dwyer, et al., Serum antibodies to HIV-1
are produced post-measles virus infection: evidence for crossreactivity with
HLA, Clin. Exp. Immunol. 111 (2) (1998) 251. [18] A.-M. Buisman, F. Abbink, R.M.
Schepp, J.A. Sonsma, T. Herremans, T. G. Kimman, Preexisting
poliovirus-specific IgA in the circulation correlates with protection against
virus excretion in the elderly, The Journal of infectious diseases 197 (5)
(2008) 698–706. [19] X. Li, Y. Song, G. Wong, J.
Cui, Bat origin of a new human coronavirus: there and back again, Science China
Life Sciences. 63 (3) (2020) 461–462. [20] Z. Wang, W. Chai, M.
Burwinkel, S. Twardziok, P. Wrede, C. Palissa, et al., Inhibitory influence of
Enterococcus faecium on the propagation of swine influenza A virus in vitro,
PloS one 8 (1) (2013). [21] B. Nielsen, G.C. Gurakan, G.
Unlu, Kefir: a multifaceted fermented dairy product, Probiotics Antimicrob
Proteins. 6 (3-4) (2014) 123–135. [22] H.C. Chen, S.Y. Wang, M.J.
Chen, Microbiological study of lactic acid bacteria in kefir grains by
culture-dependent and culture-independent methods, Food Microbiol. 25 (3) (2008)
492–501. [23] Miguel MGDCP, P.G. Cardoso, L.
de Assis Lago, R.F. Schwan, Diversity of bacteria present in milk kefir grains
using culture-dependent and culture-independent methods, Food ResInt. 43 (2010)
1523–1528. [24] E. Simova, D. Beshkova, A.
Angelov, T. Hristozova, G. Frengova, Z. Spasov, Lactic acid bacteria and yeasts
in kefir grains and kefir made from them, J. Ind. Microbiol. Biotechnol. 28 (1)
(2002) 1–6. [25] R.C. Witthuhn, T. Schoeman,
T.J. Britz, Isolation and characterization of the microbial population of
different South African kefir grains, Int JDairyTechnol 57 (2004) 33–37. [26] G. Vinderola, G. Perdigon, J.
Duarte, D. Thangavel, E. Farnworth, C. Matar, Effects of kefir fractions on
innate immunity, Immunobiology. 211 (3) (2006) 149–156. [27] H.-L. Chen, K.-F. Hung, C.-C.
Yen, C.-H. Laio, J.-L. Wang, Y.-W. Lan, et al., Kefir peptides alleviate
particulate matter< 4 μm (PM 4.0)-induced pulmonary inflammation by
inhibiting the NF-κB pathway using luciferase transgenic mice, Sci. Rep. 9 (1)
(2019) 1–13. [28] M.A. Tortorici, D. Veesler,
Structural insights into coronavirus entry, Adv. Virus Res. 105 (2019) 93–116. [29] B.W. Neuman, G. Kiss, A.H.
Kunding, D. Bhella, M.F. Baksh, S. Connelly, et al., A structural analysis of M
protein in coronavirus assembly and morphology, J. Struct. Biol. 174 (1) (2011)
1122. [30] M.L. DeDiego, E. Alvarez, ´ F.
Almazan, ´ M.T. Rejas, E. Lamirande, A. Roberts, et al., A severe acute
respiratory syndrome coronavirus that lacks the E gene is attenuated in vitro
and in vivo, J. Virol. 81 (4) (2007) 1701–1713. [31] J.L. Nieto-Torres, M.L.
DeDiego, C. Verdia-Baguena, J.M. Jimenez-Guardeno, J. A. Regla-Nava, R.
Fernandez-Delgado, et al., Severe acute respiratory syndrome coronavirus
envelope protein ion channel activity promotes virus fitness and pathogenesis,
PLoS Pathog. 10 (5) (2014). [32] L. Cui, H. Wang, Y. Ji, J.
Yang, S. Xu, X. Huang, et al., The nucleocapsid protein of coronaviruses acts
as a viral suppressor of RNA silencing in mammalian cells, J. Virol. 89 (17)
(2015) 9029–9043. [33] S. Belouzard, J.K. Millet,
B.N. Licitra, G.R. Whittaker, Mechanisms of coronavirus cell entry mediated by
the viral spike protein, Viruses 4 (6) (2012) 1011–1033. [34] S. Perlman, J. Netland,
Coronaviruses post-SARS: update on replication and pathogenesis, Nat. Rev.
Microbiol. 7 (6) (2009) 439–450. [35] L. Enjuanes, F. Almaz´ an, I.
Sola, S. Zuniga, ˜ Biochemical aspects of coronavirus replication and
virus-host interaction, Annu. Rev. Microbiol. 60 (2006) 211–230. [36] A.R. Fehr, S. Perlman,
Coronaviruses: an Overview of Their Replication and Pathogenesis.
Coronaviruses, Springer, 2015, pp. 1–23. [37] A. Shulla, T. Heald-Sargent,
G. Subramanya, J. Zhao, S. Perlman, T. Gallagher, A transmembrane serine
protease is linked to the severe acute respiratory syndrome coronavirus
receptor and activates virus entry, J. Virol. 85 (2) (2011) 873–882. [38] S. Bertram, I. Glowacka, M.A.
Müller, H. Lavender, K. Gnirss, I. Nehlmeier, et al., Cleavage and activation
of the severe acute respiratory syndrome coronavirus spike protein by human
airway trypsin-like protease, J. Virol. 85 (24) (2011) 13363–13372. [39] S.R. Weiss, S. Navas-Martin,
Coronavirus pathogenesis and the emerging pathogen severe acute respiratory
syndrome coronavirus, Microbiol. Mol. Biol. Rev. 69 (4) (2005) 635–664. [40] C.A. de Haan, P.J. Rottier,
Molecular interactions in the assembly of coronaviruses, Adv. Virus Res. 64
(2005) 165–230. [41] E. de Wit, N. van Doremalen,
D. Falzarano, V.J. Munster, SARS and MERS: recent insights into emerging
coronaviruses, Nat. Rev. Microbiol. 14 (8) (2016) 523. [42] G. Kampf, D. Todt, S.
Pfaender, E. Steinmann, Persistence of coronaviruses on inanimate surfaces and
its inactivation with biocidal agents, J. Hosp. Infect. (2020). [43] O. Zolnikova, I. Komkova, N.
Potskherashvili, A. Trukhmanov, V. Ivashkin, Application of probiotics for
acute respiratory tract infections, Ital. J. Med. 12 (1) (2018) 32–38. [44] M.C.G. Font´an, S. Martínez,
I. Franco, J. Carballo, Microbiological and chemical changes during the
manufacture of Kefir made from cows’ milk, using commercial starter culture,
Int. Dairy J. 16 (7) (2006) 762–767. [45] F. Serafini, F. Turroni, P.
Ruas-Madiedo, G.A. Lugli, C. Milani, S. Duranti, et al., Kefir fermented milk
and kefiran promote growth of Bifidobacterium bifidum PRL2010 and modulate its
gene expression, Int. J. Food Microbiol. 178 (2014) 50–59. [46] G.L. Garrote, A.G. Abraham,
G.L. De Antoni, Microbial interactions in Kefir: a natural probiotic drink.
Biotechnology of Lactic Acid Bacteria: Novel Applications, 2010, p. 327. [47] Z. Chen, J. Shi, X. Yang, B.
Nan, Y. Liu, Z. Wang, Chemical and physical characteristics and antioxidant
activities of the exopolysaccharide produced by Tibetan kefir grains during
milk fermentation, Int. Dairy J. 43 (2015) 15–21. [48] B.C. Bourrie, B.P. Willing,
P.D. Cotter, The microbiota and health promoting characteristics of the
fermented beverage kefir, Front. Microbiol. 7 (2016) 647. [49] H. Radhouani, C. Goncalves,
F.R. Maia, J.M. Oliveira, R.L. Reis, Biological performance of a promising
Kefiran-biopolymer with potential in regenerative medicine applications: a
comparative study with hyaluronic acid, J. Mater. Sci. Mater. Med. 29 (8)
(2018) 124. [50] M. Bensmira, C. Nsabimana, B.
Jiang, Effects of fermentation conditions and homogenization pressure on the
rheological properties of Kefir, LWT-Food Science and Technology. 43 (8) (2010)
1180–1184. [51] D.Z. Vasiljevi´c, A. Mansouri,
L. Anzi, R. Sordan, G.M. Stojanovi´c, Performance analysis of flexible ink-jet
printed humidity sensors based on graphene oxide, IEEE Sens. J. 18 (11) (2018)
4378–4383. [52] P.P. McCue, K. Shetty, A model
for the involvement of lignin degradation enzymes in phenolic antioxidant mobilization
from whole soybean during solidstate bioprocessing by Lentinus edodes, Process.
Biochem. 40 (3–4) (2005) 1143–1150. [53] K.L. Rodrigues, L.R.G. Caputo,
J.C.T. Carvalho, J. Evangelista, J.M. Schneedorf, Antimicrobial and healing
activity of kefir and kefiran extract, Int. J. Antimicrob. Agents 25 (5) (2005)
404–408. [54] G.L. Garrote, A.G. Abraham,
G.L. De Antoni, Chemical and microbiological characterisation of kefir grains,
J. Dairy Res. 68 (4) (2001) 639–652. [55] A.A. Ismaiel, M.F. Ghaly, A.K.
El-Naggar, Milk kefir: ultrastructure, antimicrobial activity and efficacy on
aflatoxin B1 production by Aspergillus flavus, Curr. Microbiol. 62 (5) (2011)
1602–1609. [56] G. Vinderola, G. Perdigon, ´
J. Duarte, E. Farnworth, C. Matar, Effects of the oral administration of the
products derived from milk fermentation by kefir microflora on immune
stimulation, J. Dairy Res. 73 (4) (2006) 472–479. [57] M. Medrano, P.F. P´erez, A.G.
Abraham, Kefiran antagonizes cytopathic effects of Bacillus cereus
extracellular factors, Int. J. Food Microbiol. 122 (1–2) (2008) 1–7. [58] Leite AMdO, M.A.L. Miguel,
R.S. Peixoto, A.S. Rosado, J.T. Silva, V.M. F. Paschoalin, Microbiological,
technological and therapeutic properties of kefir: a natural probiotic
beverage, Braz. J. Microbiol. 44 (2) (2013) 341–349. [59] K. ZAJSEK, ˇ M. Kolar, A.
GORSEK, ˇ Characterisation of the exopolysaccharide kefiran produced by lactic
acid bacteria entrapped within natural kefir grains, Int. J. Dairy Technol. 64
(4) (2011) 544–548. [60] P.S. Rimada, A.G. Abraham,
Kefiran improves rheological properties of gluconoδ-lactone induced skim milk
gels, Int. Dairy J. 16 (1) (2006) 33–39. [61] K. Zajˇsek, A. Gorˇsek, M.
Kolar, Cultivating conditions effects on kefiran production by the mixed
culture of lactic acid bacteria imbedded within kefir grains, Food Chem. 139
(1–4) (2013) 970–977. [62] A. Cevikbas, E. Yemni, F.W.
Ezzedenn, T. Yardimici, U. Cevikbas, S. Stohs, Antitumoural antibacterial and
antifungal activities of kefir and kefir grain, Phytother. Res. 8 (2) (1994)
78–82. [63] Y. Wang, Z. Ahmed, W. Feng, C.
Li, S. Song, Physicochemical properties of exopolysaccharide produced by
Lactobacillus kefiranofaciens ZW3 isolated from Tibet kefir, Int. J. Biol.
Macromol. 43 (3) (2008) 283–288. [64] K. Rodrigues, J. Carvalho, J.
Schneedorf, Anti-inflammatory properties of kefir and its polysaccharide
extract, Inflammopharmacology. 13 (5-6) (2005) 485–492. [65] C. Hill, F. Guarner, G. Reid,
G.R. Gibson, D.J. Merenstein, B. Pot, et al., Expert consensus document. The
International Scientific Association for Probiotics and Prebiotics consensus
statement on the scope and appropriate use of the term probiotic, Nat. Rev.
Gastroenterol. Hepatol. 11 (8) (2014) 506–514. [66] J.P. Tamang, K. Watanabe, W.H.
Holzapfel, Review: diversity of microorganisms in global fermented foods and
beverages, Front. Microbiol. 7 (2016) 377. [67] A.Y. Tamime, Fermented milks:
a historical food with modern applications–a review, Eur. J. Clin. Nutr. 56
(Suppl 4) (2002) S2–S15. [68] M. Bensmira, B. Jiang, Total
phenolic compounds and antioxidant activity of a novel peanut based kefir, Food
Sci. Biotechnol. 24 (3) (2015) 1055–1060. [69] S. Sarkar, Potential of kefir
as a dietetic beverage–a review, Br. Food J. (2007). [70] E. Simova, Z. Simov, D.
Beshkova, G. Frengova, Z. Dimitrov, Z. Spasov, Amino acid profiles of lactic
acid bacteria, isolated from kefir grains and kefir starter made from them,
Int. J. Food Microbiol. 107 (2) (2006) 112–123. [71] D. Bakircioglu, N.
Topraksever, S. Yurtsever, M. Kizildere, Y.B. Kurtulus, Investigation of macro,
micro and toxic element concentrations of milk and fermented milks products by
using an inductively coupled plasma optical emission spectrometer, to improve
food safety in Turkey, Microchem. J. 136 (2018) 133–138. [72] U. Grohmann, V. Bronte,
Control of immune response by amino acid metabolism, Immunol. Rev. 236 (1)
(2010) 243–264. [73] F. Bifari, E. Nisoli,
Branched-chain amino acids differently modulate catabolic and anabolic states
in mammals: a pharmacological point of view, Br. J. Pharmacol. 174 (11) (2017)
1366–1377. [74] J. Heineman, S. Bubenik, S.
McClave, R. Martindale, Fighting fire with fire: is it time to use probiotics
to manage pathogenic bacterial diseases? Curr. Gastroenterol. Rep. 14 (4)
(2012) 343–348. [75] T. Ichinohe, I.K. Pang, Y.
Kumamoto, D.R. Peaper, J.H. Ho, T.S. Murray, et al., Microbiota regulates
immune defense against respiratory tract influenza A virus infection, Proc.
Natl. Acad. Sci. 108 (13) (2011) 5354–5359. [76] S. Guandalini, Probiotics for
prevention and treatment of diarrhea, J. Clin. Gastroenterol. 45 (Suppl) (2011)
S149–53. [77] P. Pimentel-Nunes, J.B.
Soares, R. Roncon-Albuquerque Jr., M. Dinis-Ribeiro, A. F. Leite-Moreira,
Toll-like receptors as therapeutic targets in gastrointestinal diseases, Expert
Opin. Ther. Targets 14 (4) (2010) 347–368. [78] L. Lehtoranta, A. Pitkaranta,
R. Korpela, Probiotics in respiratory virus infections, Eur. J. Clin.
Microbiol. Infect. Dis. 33 (8) (2014) 1289–1302. [79] M.K. Park, V. Ngo, Y.M. Kwon,
Y.T. Lee, S. Yoo, Y.H. Cho, et al., Lactobacillus plantarum DK119 as a
probiotic confers protection against influenza virus by modulating innate
immunity, PLoS One 8 (10) (2013), e75368. [80] S. Salminen, S. Nybom, J.
Meriluoto, M.C. Collado, S. Vesterlund, H. El-Nezami, Interaction of probiotics
and pathogens—benefits to human health? Curr. Opin. Biotechnol. 21 (2) (2010)
157–167. [81] I. Al Kassaa, D. Hober, M.
Hamze, N.E. Chihib, D. Drider, Antiviral potential of lactic acid bacteria and
their bacteriocins, Probiotics Antimicrob. Proteins 6 (3–4) (2014) 177–185. [82] T. Takano, Anti-hypertensive
activity of fermented dairy products containing biogenic peptides, Antonie Van
Leeuwenhoek 82 (1–4) (2002) 333–340. [83] N.P. Moller, ¨ K.E.
Scholz-Ahrens, N. Roos, J. Schrezenmeir, Bioactive peptides and proteins from
foods: indication for health effects, Eur. J. Nutr. 47 (4) (2008) 171–182. [84] H. Yasui, J. Kiyoshima, T.
Hori, K. Shida, Protection against influenza virus infection of mice fed
Bifidobacterium breve YIT4064, Clin. Diagn. Lab. Immunol. 6 (2) (1999) 186–192. [85] R.C. de Gutierrez, V. Santos,
M.E. Nader-Macías, Protective effect of intranasally inoculated Lactobacillus
fermentum against Streptococcus pneumoniae challenge on the mouse respiratory
tract, FEMS Immunol. Med. Microbiol. 31 (3) (2001) 187–195. [86] C. Aldinucci, L. Bellussi, G.
Monciatti, G. Passali, L. Salerni, D. Passali, et al., Effects of dietary
yoghurt on immunological and clinical parameters of rhinopathic patients, Eur.
J. Clin. Nutr. 56 (12) (2002) 1155–1161. [87] C.G. Vinderola, J. Duarte, D.
Thangavel, G. Perdigon, ´ E. Farnworth, C. Matar, Immunomodulating capacity of
kefir, J. Dairy Res. 72 (2) (2005) 195–202. [88] G. Perdigon, M.E.N. de Macias,
S. Alvarez, G. Oliver, A.A.P. De Ruiz Holgado, Prevention of gastrointestinal
infection using immunobiological methods with milk fermented with Lactobacillus
casei and Lactobacillus acidophilus, J. Dairy Res. 57 (2) (1990) 255–264. [89] G. Perdigon, M. De Macias, S.
Alvarez, G. Oliver, A.P. de Ruiz Holgado, Systemic augmentation of the immune
response in mice by feeding fermented milks with Lactobacillus casei and
Lactobacillus acidophilus, Immunology 63 (1) (1988) 17. [90] P.G. Cano, G. Perdigon, ´
Probiotics induce resistance to enteropathogens in a renourished mouse model,
J. Dairy Res. 70 (4) (2003) 433–440. [91] E. Can, F. Kutluyer, F.D.
Sonay, O ¨ Kose, ¨ The use of kefir as potential probiotic in Çoruh trout
(Salmo coruhensis): effects on growth performance and immunoglobulin (IgM)
levels, Afr. J. Biotechnol. 11 (30) (2012) 7775–7780. [92] K. Thoreux, D.L. Schmucker,
Kefir milk enhances intestinal immunity in young but not old rats, J. Nutr. 131
(3) (2001) 807–812. [93] B.J. Umlauf, I.G.
Ovsyannikova, I.H. Haralambieva, R.B. Kennedy, R.A. Vierkant, V.S. Pankratz, et
al., Correlations between vaccinia-specific immune responses within a cohort of
armed forces members, Viral Immunol. 24 (5) (2011) 415–420. [94] T.J. Braciale, Y.S. Hahn,
Immunity to viruses, Immunol. Rev. 255 (1) (2013). [95] Nanis G. Allam, Mohamed L.
Salem, Hassan Elbatae, Nabieh MM, Lactobacillus acidophilus and Bifidobacteria
spp having antibacterial and antiviral effects on chronic HCV infection, Afr.
J. Microbiol. Res. 13 (5) (2018). [96] E. Isolauri, Y. Sütas, P.
Kankaanp¨a¨ a, H. Arvilommi, S. Salminen, Probiotics: effects on immunity, Am.
J. Clin. Nutr. 73 (2) (2001) 444s–450s. [97] Y.-P. Chen, Y.-P. Chen,
Effects of Lactobacillus kefiranofaciens M1 isolated from kefir grains on
germ-free mice, PLoS One 8 (11) (2013). [98] S.J. Gabryszewski, O. Bachar,
K.D. Dyer, C.M. Percopo, K.E. Killoran, J. B. Domachowske, et al.,
Lactobacillus-mediated priming of the respiratory mucosa protects against
lethal pneumovirus infection, J. Immunol. 186 (2) (2011) 1151–1161. [99] A. Berggren, I.L. Ahr´en, N.
Larsson, G. Onning, ¨ Randomised, double-blind and placebo-controlled study
using new probiotic lactobacilli for strengthening the body immune defence
against viral infections, Eur. J. Nutr. 50 (3) (2011) 203–210. [100] V.Q. Cavicchioli, O.V.
Carvalho, J.C. Paiva, S.D. Todorov, A. Silva Junior, L. A. Nero, Inhibition of
herpes simplex virus 1 (HSV-1) and poliovirus (PV-1) by bacteriocins from
lactococcus lactis subsp. Lactis and enterococcus durans strains isolated from
goat milk, Int. J. Antimicrob. Agents 51 (1) (2018) 33–37. [101] G. Weiss, S. Rasmussen, L.H.
Zeuthen, B.N. Nielsen, H. Jarmer, L. Jespersen, et al., Lactobacillus
acidophilus induces virus immune defence genes in murine dendritic cells by a
Toll-like receptor-2-dependent mechanism, Immunology. 131 (2) (2010) 268–281. [102] A. Adiloglu, ˘ N. Gonülates ¨
¸, M. Is¸ler, A. Senol, The effect of kefir consumption on human immune system:
a cytokine study, Mikrobiyol. Bul. 47 (2) (2013) 273–281. [103] C. Chen, X. Zhang, Z. Ju, W.
He, Advances in the research of cytokine storm mechanism induced by Corona
Virus Disease 2019 and the corresponding immunotherapies, Zhonghua shao shang
za zhi= Zhonghua shaoshang zazhi= Chinese journal of burns 36 (2020) E005. [104] G. Monteleone, P.C.
Sarzi-Puttini, S. Ardizzone, Preventing COVID-19-induced pneumonia with
anticytokine therapy. The Lancet Rheumatology, 2020. [105] D.D. Rosa, ŁM. Grze´skowiak,
C.L. Ferreira, A.C.M. Fonseca, S.A. Reis, M.M. Dias, et al., Kefir reduces
insulin resistance and inflammatory cytokine expression in an animal model of metabolic
syndrome, Food Funct. 7 (8) (2016) 3390–3401. [106] Gabrielle Ribeiro de Andrade,
Irys Viana Neves, Vaniky Duarte Marques, Monamaris Marques Borges, Tiago
Antonio Martinhago Broring, Marina Tavaresdos Anjos, et al., Influence of a
kefir-derived antimicrobial fraction on zika virus cytopathic effects and
lymphocyte proliferation, JOJ Immuno Virology. 2 (2) (2017). [107] M. Seo, E. Park, S. Ko, E.
Choi, S. Kim, Therapeutic effects of kefir grain Lactobacillus-derived
extracellular vesicles in mice with 2, 4, 6-trinitrobenzene sulfonic
acid-induced inflammatory bowel disease, J. Dairy Sci. 101 (10) (2018)
8662–8671. [108] B.M. Morsy, A.M. Mahmoud,
M.I. Zanaty, A. Abdel-Moneim, M.A. Abo-Seif, Beneficial effects of milk kefir
in patients with chronic hepatitis C virus infection, Int. J. Bioassays 3 (6)
(2014) 3086–3091. [109] P. Carasi, S.M. Racedo, C.
Jacquot, D.E. Romanin, M. Serradell, M. Urdaci, Impact of kefir derived
Lactobacillus kefiri on the mucosal immune response and gut microbiota, J.
Immunol. Res. 2015 (2015). [110] G. Spiteri, J. Fielding, M.
Diercke, C. Campese, V. Enouf, A. Gaymard, et al., First cases of coronavirus
disease 2019 (COVID-19) in the WHO European Region, 24 January to 21 February
2020, Euro Surveill. 25 (9) (2020). [111] J. Villena, M.L.S. Oliveira,
P.C. Ferreira, S. Salva, S. Alvarez, Lactic acid bacteria in the prevention of
pneumococcal respiratory infection: future opportunities and challenges, Int.
Immunopharmacol. 11 (11) (2011) 1633–1645. [112] W.-T. Lei, P.-C. Shih, S.-J.
Liu, C.-Y. Lin, T.-L. Yeh, Effect of probiotics and prebiotics on immune
response to influenza vaccination in adults: a systematic review and
meta-analysis of randomized controlled trials, Nutrients. 9 (11) (2017) 1175. [113] K.P. Fernandez-Duarte, N.N.
Olaya-Galan, S.P. Salas-Cardenas, J. Lopez-Rozo, M. F. Gutierrez-Fernandez,
Bifidobacterium adolescentis (DSM 20083) and Lactobacillus casei (Lafti
L26-DSL): probiotics able to block the in vitro adherence of rotavirus in MA104
cells, Probiotics Antimicrob. Proteins 10 (1) (2018) 56–63. [114] N.N. Olaya Galan, J.C. Ulloa
Rubiano, F.A. Velez Reyes, K.P. Fernandez Duarte, S. P. Salas Cardenas, M.F.
Gutierrez Fernandez, In vitro antiviral activity of Lactobacillus casei and
Bifidobacterium adolescentis against rotavirus infection monitored by NSP4
protein production, J. Appl. Microbiol. 120 (4) (2016) 1041–1051. [115] D. Starosila, S. Rybalko, L.
Varbanetz, N. Ivanskaya, I. Sorokulova, Anti-influenza activity of a Bacillus
subtilis probiotic strain, Antimicrob. Agents Chemother. 61 (7) (2017). [116] M. Ghoneum, N. Felo, S.
Agrawal, A. Agrawal, A novel kefir product (PFT) activates dendritic cells to
induce CD4+ T and CD8+ T cell responses in vitro, Int. J. Immunopathol.
Pharmacol. 28 (4) (2015) 488–496. [117] T. Panavas, E. Serviene, J.
Brasher, P.D. Nagy, Yeast genome-wide screen reveals dissimilar sets of host genes affecting
replication of RNA viruses, Proc. Natl. Acad. Sci. 102 (20) (2005) 7326–7331. [118] D.B. Kushner, B.D.
Lindenbach, V.Z. Grdzelishvili, A.O. Noueiry, S.M. Paul, P. Ahlquist,
Systematic, genome-wide identification of host genes affecting replication of a
positive-strand RNA virus, Proc. Natl. Acad. Sci. 100 (26) (2003) 15764–15769. [119] A.B. Parsons, A. Lopez, I.E.
Givoni, D.E. Williams, C.A. Gray, J. Porter, et al., Exploring the
mode-of-action of bioactive compounds by chemical-genetic profiling in yeast,
Cell. 126 (3) (2006) 611–625. [120] J.A. Song, H.J. Kim, S.K.
Hong, D.H. Lee, S.W. Lee, C.S. Song, et al., Oral intake of Lactobacillus
rhamnosus M21 enhances the survival rate of mice lethally infected with
influenza virus, J. Microbiol. Immunol. Infect. 49 (1) (2016) 16–23. [121] J.Y. Bae, J.I. Kim, S. Park,
K. Yoo, J.I.H. Kim, W. Joo, et al., Effects of Lactobacillus plantarum and
Leuconostoc mesenteroides probiotics on human seasonal and avian influenza
viruses, J. Microbiol. Biotechnol. 28 (6) (2018) 893–901. [122] Hwa-Jung Choi, Jae-Hyoung
Song, Young-Joon Ahn, Seung-Hwa Baek, D.- H. Kwon, Antiviral activities of
cell-free supernatants of yogurts metabolites against some RNA viruses,
European Food Research and Technology 228 (2009) 945–950. [123] T. Maruo, Y. Gotoh, H.
Nishimura, S. Ohashi, T. Toda, K. Takahashi, Oral administration of milk
fermented with Lactococcus lactis subsp. Cremoris FC protects mice against
influenza virus infection, Lett. Appl. Microbiol. 55 (2) (2012) 135–140. [124] H. Goto, A. Sagitani, N.
Ashida, S. Kato, T. Hirota, T. Shinoda, et al., Antiinfluenza virus effects of
both live and non-live Lactobacillus acidophilus L-92 accompanied by the
activation of innate immunity, Br. J. Nutr. 110 (10) (2013). [125] Irfan A. Rather, Kwang-Ho
Choi, Vivek K. Bajpai, Y.-H. Park, Antiviral mode of action of Lactobacillus
plantarum YML009 on Influenza virus H1N1, A Journal of the Bangladesh
Pharmacological Society (BDPS). 10 (2015) 475–482. [126] K. Eguchi, N. Fujitani, H.
Nakagawa, T. Miyazaki, Prevention of respiratory syncytial virus infection with
probiotic lactic acid bacterium Lactobacillus gasseri SBT2055, Sci. Rep. 9 (1)
(2019) 4812. [127] K. Jung, Y. Ha, S.K. Ha, D.U.
Han, D.W. Kim, W.K. Moon, et al., Antiviral effect of Saccharomyces cerevisiae
beta-glucan to swine influenza virus by increased production of
interferon-gamma and nitric oxide, J. Vet. Med. B Infect. Dis. Vet. Public
Health 51 (2) (2004) 72–76. [128] M. Frieman, D. Basu, K.
Matthews, J. Taylor, G. Jones, R. Pickles, et al., Yeast based small molecule
screen for inhibitors of SARS-CoV, PLoS One 6 (12) (2011). [129] J.Y. Kang, D.K. Lee, N.J. Ha,
H.S. Shin, Antiviral effects of Lactobacillus ruminis SPM0211 and
Bifidobacterium longum SPM1205 and SPM1206 on rotavirusinfected Caco-2 cells
and a neonatal mouse model, J. Microbiol. 53 (11) (2015) 796–803. [130] D.K. Lee, J.E. Park, M.J.
Kim, J.G. Seo, J.H. Lee, N.J. Ha, Probiotic bacteria, B. Longum and L.
Acidophilus inhibit infection by rotavirus in vitro and decrease the duration
of diarrhea in pediatric patients, Clin. Res. Hepatol. Gastroenterol. 39 (2)
(2015) 237–244. [131] S. Khani, M. Motamedifar, H.
Golmoghaddam, H.M. Hosseini, Z. Hashemizadeh, In vitro study of the effect of a
probiotic bacterium Lactobacillus rhamnosus against herpes simplex virus type
1, Braz. J. Infect. Dis. 16 (2) (2012) 129–135. [132] P. Mastromarino, F.
Cacciotti, A. Masci, L. Mosca, Antiviral activity of Lactobacillus brevis
towards herpes simplex virus type 2: role of cell wall associated components,
Anaerobe. 17 (6) (2011) 334–336 [133] E. Mousavi, M. Makvandi, A.
Teimoori, A. Ataei, S. Ghafari, A. Samarbaf-Zadeh, Antiviral effects of
Lactobacillus crispatus against HSV-2 in mammalian cell lines, J. Chin. Med.
Assoc. 81 (3) (2018) 262–267. [134] A.A. Sunmola, O.O. Ogbole,
T.O.C. Faleye, A. Adetoye, J.A. Adeniji, F.A. Ayeni, Antiviral potentials of
Lactobacillus plantarum, Lactobacillus amylovorus, and Enterococcus hirae
against selected Enterovirus, Folia Microbiol (Praha). 64 (2) (2019) 257–264. [135] H. Kuang, P. Yang, L. Yang,
Z.P. Aguilar, H. Xu, Size dependent effect of ZnO nanoparticles on endoplasmic
reticulum stress signaling pathway in murine liver, J. Hazard. Mater. 317
(2016) 119–126. [136] M.P. Arena, F. Elmastour, F.
Sane, D. Drider, D. Fiocco, G. Spano, et al., Inhibition of coxsackievirus B4
by Lactobacillus plantarum, Microbiol. Res. (Pavia) 210 (2018) 59–64. [137] H.A. Aboubakr, A.A. El-Banna,
M.M. Youssef, S.A. Al-Sohaimy, S.M. Goyal, Antiviral effects of Lactococcus
lactis on feline calicivirus, a human norovirus surrogate, Food Environ. Virol.
6 (4) (2014) 282–289. [138] R. Karaçalı, N. Ozdem ¨ ˙Ir,
A.H. Çon, Aromatic and functional aspects of kefir produced using soya milk and
Bifidobacterium species, Int. J. Dairy Technol. 71 (4) (2018) 921–933. [139] M. Rea, T. Lennartsson, P.
Dillon, F. Drinan, W. Reville, M. Heapes, et al., Irish kefir-like grains:
their structure, microbial composition and fermentation kinetics, J. Appl.
Bacteriol. 81 (1) (1996) 83–94. [140] N. Talib, N.E. Mohamad, S.K.
Yeap, Y. Hussin, M.N.M. Aziz, M.J. Masarudin, et al., Isolation and
characterization of Lactobacillus spp. From kefir samples in Malaysia,
Molecules. 24 (14) (2019) 2606. [141] L.S. Sturman, C. Ricard, K.
Holmes, Conformational change of the coronavirus peplomer glycoprotein at pH
8.0 and 37 degrees C correlates with virus aggregation and virus-induced cell
fusion, J. Virol. 64 (6) (1990) 3042–3050. [142] U. Nalbantoglu, A. Cakar, H.
Dogan, N. Abaci, D. Ustek, K. Sayood, et al., Metagenomic analysis of the
microbial community in kefir grains, Food Microbiol. 41 (2014) 42–51. [143] L. Angulo, E. Lopez, C. Lema,
Microflora present in kefir grains of the Galician region (North-West of Spain),
J. Dairy Res. 60 (2) (1993) 263–267. [144] D.F. Zanirati, M. Abatemarco
Jr, S.H. de Cicco Sandes, J.R. Nicoli, AC. ´ Nunes, E. Neumann, Selection of
lactic acid bacteria from Brazilian kefir grains for potential use as starter
or probiotic cultures, Anaerobe. 32 (2015) 70–76. [145] A. Santos, M. San Mauro, A.
Sanchez, J. Torres, D. Marquina, The antimicrobial properties of different
strains of Lactobacillus spp. Isolated from kefir, Syst. Appl. Microbiol. 26
(3) (2003) 434–437. [146] A. Dobson, O. O’Sullivan,
P.D. Cotter, P. Ross, C. Hill, High-throughput sequencebased analysis of the
bacterial composition of kefir and an associated kefir grain, FEMS Microbiol.
Lett. 320 (1) (2011) 56–62. [147] C. Garofalo, A. Osimani, V.
Milanovi´c, L. Aquilanti, F. De Filippis, G. Stellato, et al., Bacteria and
yeast microbiota in milk kefir grains from different Italian regions, Food
Microbiol. 49 (2015) 123–133. [148] M.E. Pintado, J.L. Da Silva,
P.B. Fernandes, F.X. Malcata, T.A. Hogg, Microbiological and rheological
studies on Portuguese kefir grains, Int. J. Food Sci. Technol. 31 (1) (1996)
15–26. [149] I. Mainville, N. Robert, B.
Lee, E.R. Farnworth, Polyphasic characterization of the lactic acid bacteria in
kefir, Syst. Appl. Microbiol. 29 (1) (2006) 59–68. [150] Z. Yüksekdag, ˘ Y. Beyatli,
B. Aslim, Determination of some characteristics coccoid forms of lactic acid
bacteria isolated from Turkish kefirs with natural probiotic, LWT Food Sci.
Technol. 37 (6) (2004) 663–667. [151] N. Korsak, B. Taminiau, M.
Leclercq, C. Nezer, S. Crevecoeur, C. Ferauche, et al., Evaluation of the
microbiota of kefir samples using metagenetic analysis targeting the 16S and
26S ribosomal DNA fragments, J. Dairy Sci. 98 (6) (2015) 3684–3689. [152] A.J. Marsh, O. O’Sullivan, C.
Hill, R.P. Ross, P.D. Cotter, Sequencing-based analysis of the bacterial and
fungal composition of kefir grains and milks from multiple sources, PLoS One 8
(7) (2013). [153] L. Latorre-García, L. del
Castillo-Agudo, J. Polaina, Taxonomical classification of yeasts isolated from
kefir based on the sequence of their ribosomal RNA genes, World J. Microbiol.
Biotechnol. 23 (6) (2007) 785–791. [154] D. Marquina, A. Santos, I.
Corpas, J. Munoz, J. Zazo, J. Peinado, Dietary influence of kefir on microbial
activities in the mouse bowel, Lett. Appl. Microbiol. 35 (2) (2002) 136–140. [155] T. Vardjan, P.M. Lorbeg, I.
Rogelj, A.C. ˇ Majheniˇc, Characterization and stability of lactobacilli and
yeast microbiota in kefir grains, J. Dairy Sci. 96 (5) (2013) 2729–2736. [156] G. Diosma, D.E. Romanin, M.F.
Rey-Burusco, A. Londero, G.L. Garrote, Yeasts from kefir grains: isolation,
identification, and probiotic characterization, World J. Microbiol. Biotechnol.
30 (1) (2014) 43–53.
